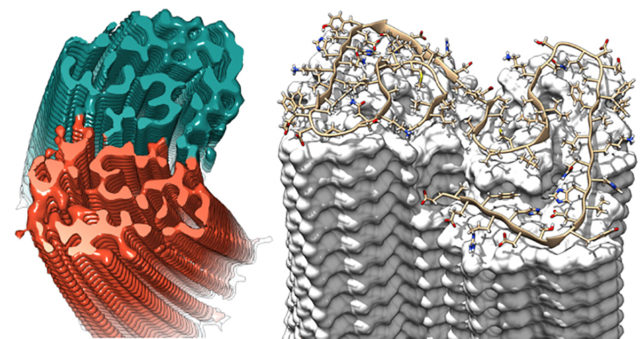
Ursächlich für die Alzheimer-Krankheit sind vermutlich weniger die mikroskopisch gut sichtbaren Ablagerungen selbst als vielmehr schon deren Vorläuferaggregate, die Oligomere. Das sind Eiweißverbindungen, die sich aus mehreren Eiweißbruchstücken – in diesem Fall: Aβ-Peptide – zusammensetzen. Diese können die Zellmembran zerstören oder Zellen über die Aktivierung von Rezeptoren vergiften und führen so womöglich den Tod von Nervenzellen herbei.
Mithilfe von atomgenauen Simulationen der Molekulardynamik auf dem Jülicher Superrechner JURECA konnten Forscher des Institute of Complex Systems die Oligomere bestimmen, die für die Ausbildung der alzheimertypischen Fibrillen entscheidend sind. Die treibenden Kräfte sind demnach längliche oder ausgedehnte Oligomere. Diese neigen stark dazu, Verbindungen mit anderen Oligomeren einzugehen und sind aus diesem Grund sehr kurzlebig. Experimentell lassen sich gewöhnlich daher nur die kompakten, „verknäulten“ Formen von Oligomeren beobachten, die in einem viel schwächeren Maße am Aggregationsprozess beteiligt und damit stabiler sind.
Die Ergebnisse liefern zudem eine Erklärung, warum eine der beiden Aß-Varianten deutlich schädlicher ist als die andere. Die relevanten Eiweißfragmente bestehen hauptsächlich aus 40 oder 42 Aminosäuren, wobei die längere Variante als deutlich toxischer gilt. In den Simulationen zeigte sich, dass sich das langkettige Aβ42 eher zu stabilen Oligomeren aus drei oder vier Eiweißbruchstücken zusammenschließt als das etwas kürzere Aβ40. Die gebildeten Aβ42-Oligomere weisen außerdem eine stärkere hydrophobe – also wasserabweisende – Oberfläche auf. Diese Eigenschaft konnte in vorangegangen Experimenten direkt mit einer zellschädigenden Wirkung in Zusammenhang gebracht werden.